
السلام عليكم ورحمة الله وبركاته الجزىء هو اصغر جزء من المادة يحمل صفاته ويمكن ان نحصل عليه من عملية تقسيمها الى حد معين يتكون الجزىء من حبيبات صغيرة جدا تسمى الذرات
هل اعجبكم الموضوع؟؟؟
شكرا لك وجزاك الله خيرا عجبني كتير
شكراعلى المعلومة
شكرالكم على الموضوع
شكرا لكم على الاقتباس
شكراعلى المعلومة 3:

أريد حلول تمارين الكتاب المدرسي في الفيزياء للسنة 2متوسط
من صفحة 114
إلى
صفحة 117
و هذه أول مشارك لي في المنتدى .
أقترح عليكِ تصفح الرابط التالي علكِ تجدين ما تريدين:
http://www.ouarsenis.com/vb/showthread.php?t=13584
بالتوفيق
ألف شكرا لك أختي إنشاء الله يجعلها في ميزان حسناتك و مرة ثانية ألف شكر
أم كلثوم طول عمرها تساعد الناس

اليوم جبت حلول كتاب الفيزياء (علوم فيزيائية وتكنولوجية )
هدية الى كل اعضاء المنتدى الذين يدروسن في السنة لثانية متوسط
حل تمارين الكتاب المدرسي فيزياء سنة الثانية متوسط
http://www.4shared.com/file/68912125…___online.html
لكن اين نظغط هذا ليس رابط
نعتذر من كل متصفح للموضوع
يبدو أن هناك خللاً بالرابط
ياسمين أرجو أن تقومي بتعديل الرابط أو سيتم حذف الموضوع
بالتوفيق
السلام عليكم جميعا.
ايتها الاخت ميساء اضغطي على ذالك الرابط ثم اضغطي على copier بعدها ثم اذهبي الى المكان المخصص لكتابة الروابط و اضغطي على اليمين coller هكذا تستطيعين زيارة الرابط و تحميل هذا الملف.
بالــــــــــــــــــــــــــــــــــــــــــتوفيق
لقد تم تعديل الرابط
بالتوفيق

ارجوك استاذ salah70
اريد حل التمرين16ص51 في اقرب وقت من فضلك احتاجه ليوم غد
استاذ ارجوك ساعدني

اريد ان تساعديني في حل هذا التمرين
التمرين :
إليك هذه المتفاعلات الكيميائية عبر عنها بإستعمال بإستعمال المعادلات الكيميائية مع موازنتها :
* الاحتراق التام لغاو البروبان (C3H8) يعطي الماء و ثاني اكسيد الكربون
* تأكسد الحديد بوجود الاكسيجين يعطي ثلاثي أكسيد الحديد الثنائي (Fe2O3)
*تفاعل معدن النحاس مع محلوزل لترات الفضة (AgNO3)يعطي معدن الفضة (Ag)و محلول لترات النحاس (Cu(NO3)
*تفاعل الكلس (CaCO3) مع محلول حمض كلور الهيدروجين (HCl)يعطي الماء و غاز ثاني اكسيد الكربون و محلول ثنائي كلور الكالسيوم (CaCl2)
آسفففففففففف

السلام عليكم
من فضلكم انا اريد حلول تمارين الفيزياء للسنة الثالثة متوسط
ارجو المساعدة
وشكرا
جـــــــــــــــــــــــــــــــ اري طلبك اختي
شكرا شكرا شكرا

السلام عليكم
انا اريد مساعدة في حل هذه التمارين
ارجوكم لاتبخلو علي و اجركم عند الله
السؤال الاول
اجب بصحيح او خطا
1- الالكترونات دقائق لها شحنة كهربائية
2-تحمل الذرة شحنة كهربائية سالبة
3- لا تحتوي الذرة على اي شحنة كهربائية
4- يوجد عدة انواع من الالكترونات
5- الجسم المشحون ايجابيا له زيادة في عدد الالكترونات
السؤال الثاني
ان قيمة الالكترون هي( 16-)10*1.6=q
يحمل جسم شحنة كهربائية …………( 14-)10*1.6=q
1-ماهو عدد الالكترونات الزائدة في هذا الجسم
2- ماهي وحدة الشحنة الكهربائية
السوال الثالث
1-هل للتيار المحرض جهة واحدة (فسر)
2- هل للتيار المحرض قيمة واحدة و ثابتة (فسر)
3- ماذا نسمي التيار المحرض
بليز مساعدة و لو بكلمة عرفتوها

لي عندوا حل التمرين رقم 13 ص 105 في الفيزياء للسنة 3 متوسط يساعدني فيه لانوا حاولت وما فهمت
ربي يخليكم
[الجواب كالاتي سرعة القطار فائق السرعة مشكورةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةةة ةةةةةةةةةةةةةةةة
الجواب هو سرعة القطار فائق السرعة
الإجابة يا صاحب السؤال وهي:
يجب عليك أولا معرفة القانون عند قراءتك من الجهاز وهو: شدة التيار الكهربائي = العيار * القراءة / السلم
بحيث عندما تستعمل جهاز الأمبير أو الفولط متر أن تعرف أين يوجد العيار والسلم
ثم بعدها توافق بين السلم والعيار إن إستعملت العيار مثلا 1 أمبير فإنك ستقرأ على السلم 100
وإن إستعملت العيار 3 أمبير سوف تقرأ في السلم 30
ولكن في هذا التمرين يوجد سلم واحد وهو 100 يعني سلم ثابت ( أي عدم وجود أكثر من سلم)
والآن عليك أن تقارب بين شدة التيار والعيار المستعمل فمثلا الأولى 0.9 أمبير فإننا سنستعمل العيار 1 أمبير الذي سيعطينا قيمة محددة أما المعيار 5 أمبير فهو كبير جدا بالنسبة لقيمة شدة التيار بحيث أن المؤشر في الجهاز يتحرك بجوار الصفر وتكون عند الرقم 9 والتدريجة تكون صغيرة جدا أما عندما نستعمل العيار 1 فالتدريجة تكون قريبة للرقم 90 أما إستعمال العيارات 1 و 10 و 100 ميلي أمبير يترك المؤشر يخرج عن التدريجة 100 ويتلف بعدها الجهاز في حالة تركه في العيارات الصغيرة.
سوف أجيب على العمود الأول للجدولوالباقي عليك)
الشدة 0.9 أمبير نختار له العيار 1 أمبير والتدريجات الموافقة نستعمل القانون السابق بحيث نستخرج منه القراءة.
القراءة = شدة التيار (i) * السلم / العيار
القراءة = 0.9 * 100 / 1
القراءة = 90 تدريجة
أي العيار 1 وعدد التدريجات 90
ظاهرة طبيعية مدهشة تجعل الشواطئ تتلألأ كالنجوم
تكتسب شواطئ البحار سحراً يجعلها أحد أجمل ما يمكن أن نراه على كوكب الأرض،
ويزداد هذا الجمال سحراً حين يضيء الشاطئ باللون الأزرق المتوهج،
صورة حقيقية لأحد الشواطئ في المالديف، فبمجرد حلول المساء تتلألأ رمال الشاطئ باللون الأزرق المدهش لتنافس النجوم ضياءً!
والسبب هو عوالق نباتية ميكروسكوبية تسمى فايتوبلانكتون تنتشر قبالة الشاطئ وعلى رماله،
ويعتقد العلماء أنها تتوهج بهذه الطريقة العجيبة لتخيف أعداءها،
فلو كنت كائناً مفترساً لا أظن أني سآكل مخلوقاً يضيء!
وهناك نظرية أخرى تقول أن الفايتوبلانكتون تستخدم هذه الإضاءة الذاتية لتجذب كائنات مفترسة أخرى لتحمي منطقة تواجدها.
لا تحدث هذه الظاهرة في المالديف فقط بل تحدث كذلك في منطقة إفرجليدز التي تقع في جنوب فلوريدا بالولايات المتحدة الأمريكية.
واليكم بعض الصور
This image has been resized. Click this bar to view the full image. The original image is sized 580×385 and weights 52KB.
This image has been resized. Click this bar to view the full image. The original image is sized 580×732 and weights 135KB.
This image has been resized. Click this bar to view the full image. The original image is sized 580×385 and weights 51KB.
This image has been resized. Click this bar to view the full image. The original image is sized 580×435 and weights 26KB.
This image has been resized. Click this bar to view the full image. The original image is sized 580×435 and weights 29KB.
This image has been resized. Click this bar to view the full image. The original image is sized 580×413 and weights 31KB.
يسلموووووووووووووووووووووووووووووووووو على المجهود

أريد أن أعرف ماهو رمز الصدأ من فضلكم أحتاجه جدااااااااااااااااااااااا
…………………………………
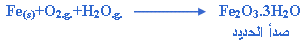
صدأ
الصدأ عبارة عن مادة حمراء ضاربة إلى اللون البني تتشكل على سطح الحديد والفولاذ كنتيجة لأثر التآكل. يتكون الصدأ من أكسدة ذرات الحديد الموجودة على السطح نتيجة التماس مع أكسجين الهواء الجوي بوجود الرطوبة. يمكن اعتبار الصدأ أكسيد مميّه للحديد، حيث يتشكل مزيج من أكسيد الحديد الثنائي FeO و أكسيد الحديد الثلاثي Fe2O3 بالإضافة إلى أكسيد هيدروكسيد الحديد الثلاثي FeO(OH)·Fe(OH)3 بوجود جزيئات الماء داخل البنية، بحيث يمكن أن تكتب الصيغة العامة المجملة له كالتالي:
يعتبر الصدأ من أهم العوامل المؤدية لضعف الحديد وهشاشته، وذلك بسبب الطبيعة المسامية لأكاسيد الحديد الناتجة. ويمكن استخدام الحديد في تشكيل سبائك بخلطه مع عناصر كيميائية أخرى لصناعة فلزات تقاوم الصدأ، ويطلق عليها الصلب غير القابل للصدأ أما الحديد والصلب اللذان لا يقاومان الصدأ فينبغي حفظهما في حالة جافة أو تشحيمهما، أو طلاءهما، أو تغليفهما بفلز أكثر نشاطًا كالخارصين فيما يعرف بعملية الغلفنة.
هذا هو رمزهFe2O3.3H2O
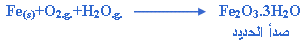


تجربة الكشف عن غاز ثاني أكسيد الكربون
الكشف عن شاردة الحديد الثلاثي
الكشف عن شاردة الكلور
التكهرب بالدلك او بالتأثير